
据统计,2015年,我国癌症新发人数为429.2万。死亡人数281.4万,平均5年生存率36.9%。肺癌、胃癌、肝癌、食管癌占到总数的57%。细胞治疗,治疗病人的个体化差异较大。细胞治疗大有向精准发展趋势。
从临床角度,目前所开展的细胞治疗大多以T细胞为基础。血液肿瘤治疗,利用肿瘤特异性抗原(TAA)作为治疗靶点,使得CAR-T细胞治疗方法已得到有效验证,取得划时代性的突破。然而,利用CAR-T细胞治疗实体瘤的临床效果未能得到充分验证。因此,寻找有效治疗靶点,成为实体瘤细胞治疗基础研究的重要方向。
人们在对免疫过程的研究中发现并证实,特异性 T 细胞激活的前提条件是 T 细胞受体(TCR)和 MHC-肽复合物结合,因此细胞毒性T细胞(CTL)表位在其中起着至关重要的作用。CTL 表位(CTL epitope)一般长度为8-10个氨基酸,是蛋白抗原经抗原递呈细胞(Antigen process cell,APC)加工处理,随后与 MHC-Ⅰ类分子结合并最终递呈给TCR识别,引起有效免疫应答的短肽。
CTL表位的筛选和鉴定在特异性 T 细胞应答检测中应用越来越广泛,同时在免疫诊断、治疗及疫苗的开发等都有重要作用。CTL表位的筛选和鉴定一直是生物治疗的关注点。但传统的表位鉴定技术大多采用先合成大量的交叠肽,然后通过后续的淋巴细胞实验进行选取。这种实验方法费时费力、费用高并且鉴定效率低。MHC四聚体技术的出现,为研究者创造了更为快捷高效的手段。
MHC四聚体(MHC Tetramer)技术,是由美国斯坦福大学John D. Altman博士等人于1996年开发,用于抗原特异性T细胞的检测。其原理是借助生物素、链霉亲和素系统,将MHC和肽形成MHC-肽四聚体复合物,增强了MHC-抗原肽复合物与TCR之间的结合力,从而可通过流式细胞技术检测或分选特异性T细胞,大大提高了特异性T细胞的检测灵敏度。该复合物制备过程如下图所示:
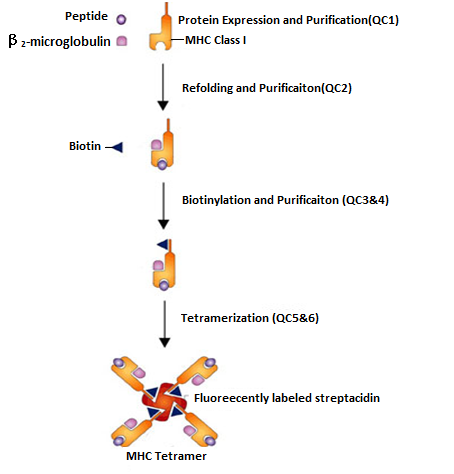
鉴于CTL 表位在免疫系统中的重要性,MHC四聚体技术在抗原特异T细胞的表位分析上的应用被高度关注。T细胞表位筛选方案一般根据所要研究的抗原肽相关蛋白,设计并合成多个交叠肽,然后将其分别制备成MHC四聚体,并进行分组,形成多组MHC肽四聚体混合物。用这些四聚体染色外周血单个核细胞(PBMC),通过流式细胞仪检测获得阳性反应组,随后将阳性反应组中所有的MHC四聚体再逐个染色PBMC鉴定,由此获得相关抗原蛋白的T细胞表位。这一筛选方案具有快速、灵敏、高效的优势。
近年来,已有研究者成功地将MHC-肽四聚体技术应用于 T细胞表位的鉴定工作。
推荐阅读:
1. Heo Y, Hwang S, Kwon O, et al. Structural aspect of novel HLA-A*02 allele, A *0286,identified by sequence-based typing[J ]. Tissue Antigens, 2006, 67 (1):84-85.
2. Altman J, Moss P, Goulder P, et al. Phenotypic analysis of antigen-specific Tlymphocytes[J].Science,1996;274(5284):94-96.
3. Murali K, Altman J, Suresh M, et al. Counting antigen-specific CD8 T cells :a revaluation of bystander activetion during viral infection[J].Immunity,1998,8 (2):177-187.
4. Novak E J, Liu A W, Gebe J A, et al. Tetramer-guided epitope mapping :rapid identification and characterization of immunodominant CD4+ T cell epitopes from complex antigens[ J].J Immunol,2001,166(11):6665-6670.
5. Reijonen H, Kwok W W. Use of HLA class II tetramers in tracking antigen-specific T cells and mapping T-cell epitopes[ J].Methods,2003,29(3):282-288.