
RAS是一种具有GTP酶活性的G蛋白,其基因是肿瘤中最常见的突变基因之一,30%的肿瘤携带RAS变异,如果算上RAS调控因子和信号通路上下游的变异,几乎覆盖所有肿瘤,RAS变异每年造成一百万以上的病人死亡,是当之无愧的肿瘤基因之王。RAS家族主要包含KRAS、HRAS、NRAS。其中,KRAS是RAS家族中最常出现的亚型,其基因突变占RAS基因突变总数的85%(NRAS(12%)次之,HRAS(3%)最少)。随着KRAS G12C小分子抑制剂AMG510(Amgen,1/2期临床)、MRTX849(MiratiTherapeutics,1/2期临床)、BI-2852(BoehringerIngelheim,临床前研究)药物的研发及其相关抗癌数据的公布,使得KRAS成为当前抗癌药物研究的热点。
1. KRAS的致癌机理
KRAS与GTP结合呈激活状态,与GDP结合呈失活状态(图1)【1】。KRAS可接受来自生长因子受体(如Her2、EGFR等)的信号并被激活,激活的Kras蛋白把信号传递给下游信号通路(如MAPK信号通路、PI3K信号通路等),促进细胞增殖。野生型的Kras蛋白在把信号传递给下游通路后迅速失活。而突变型的Kras蛋白不受上游通路的控制,持续处于激活状态,使细胞增殖不受控制,进而导致癌症的发生发展【2】。
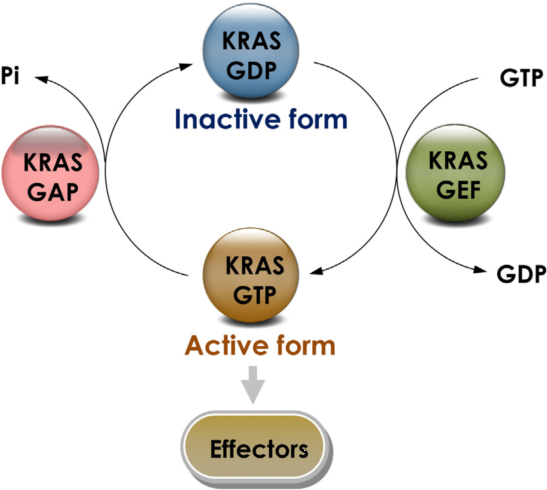
图1. KRAS GTP酶循环【1】
KRAS在激活与失活状态之间的转换受鸟嘌呤核苷酸交换因子(GEF)和GTP酶激活蛋白(GAPs)的调节。GEF蛋白催化GTP与GDP交换,使KRAS与GTP结合,促进KRAS呈激活状态;GAPs促进与KRAS结合的GTP水解成为GDP,使KRAS呈失活状态。在正常细胞中,水解和交换的稳态平衡使KRAS处于与GDP结合的失活状态;在肿瘤细胞中,由于KRAS基因突变,使得核苷酸交换活性增强、GTP水解活性减弱,导致KRAS保持与GTP结合状态,不断激活下游信号通路【3】。
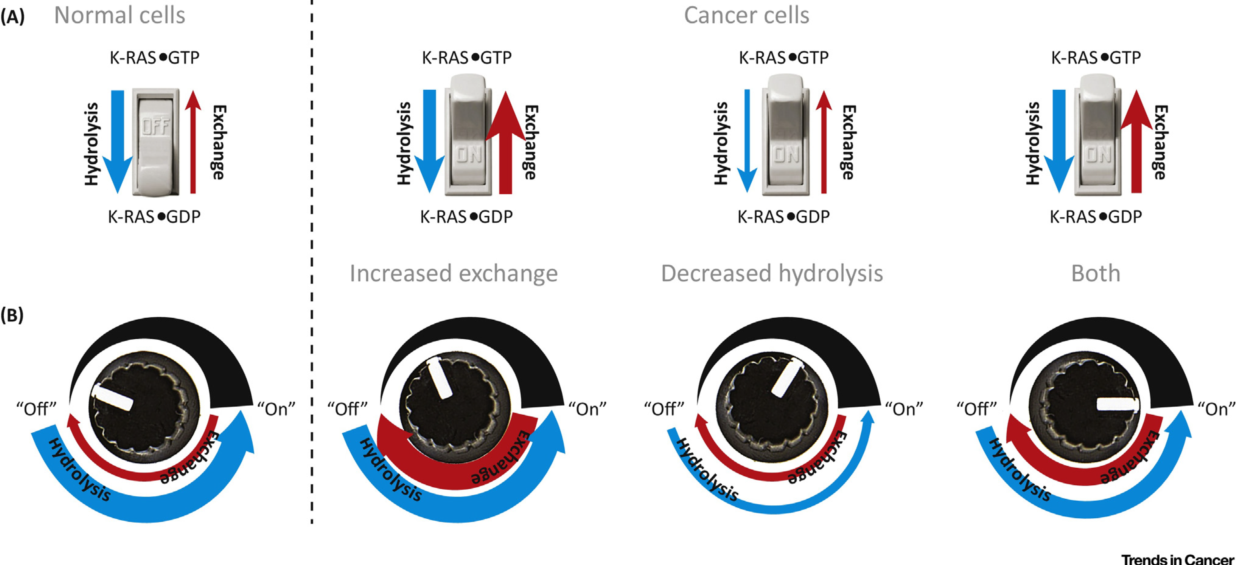
图2在正常组织及肿瘤中KRAS激活的模型【3】
2. KRAS常见突变靶点
研究发现KRAS突变主要发生在12、13、61、117和146密码子,这些突变位点破坏了KRAS-GTP和KRAS-GDP水解和交换的稳态平衡,导致KRAS持续处于KRAS-GTP状态。在胰腺导管腺癌(PDAC)、结直肠癌(CRC)和非小细胞肺癌(NSCLC)中,12位密码子突变占主导地位,占所有KRAS突变的90%(图3)【2】。进一步对12位密码子突变分析发现,在NSCLC中, G12C和G12V为最常见的突变;在PDAC中,G12D、G12V、G12R为最常见突变;在CRC中,G12D、G12V、G12C为最常见突变(图4)。
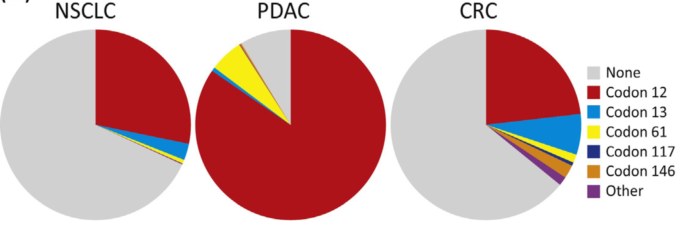
图3KRAS突变频率【2】
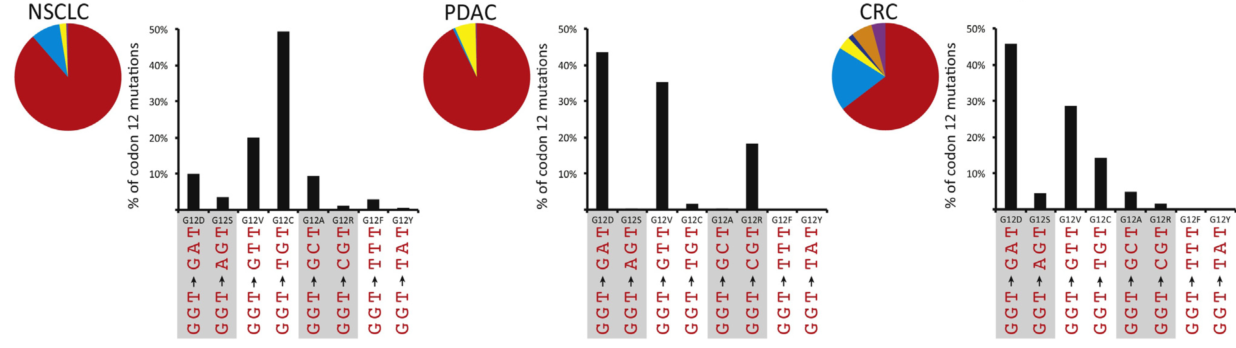
图4 KRAS第12位点突变多态性【2】
3. KRAS突变抗原肽特异性CD8+T在肿瘤免疫治疗中的应用
研究显示,针对KRAS突变位点(G12D、G12R、G13D等)设计的新生抗原肽、DNA疫苗、mRNA疫苗等可有效刺激机体产生抗原肽特异的细胞毒性T淋巴细胞(CTL),可靶向识别并杀伤相应的KRAS突变肿瘤细胞【4】。
(1)KRAS G12D抗原肽特异性CD8+T可有效靶向并杀伤结直肠癌细胞
Traner al. 2016从HLA-C*0802转移性结直肠癌患者肿瘤浸润性淋巴细胞中筛选并体外扩培靶向KRAS G12D的CD8+T细胞,将扩培的特异性CD8+T细胞对患者进行回输,在6周和9个月分别进行评估,发现转移灶1、2、4均出现消退,转移灶3在9个月出现反复与肿瘤细胞中HLA-C*0802分子缺失有关(见图5)【5】。研究发现,回输靶向KRAS G12D特异性CD8+T细胞,是一种有效的肿瘤免疫疗法。
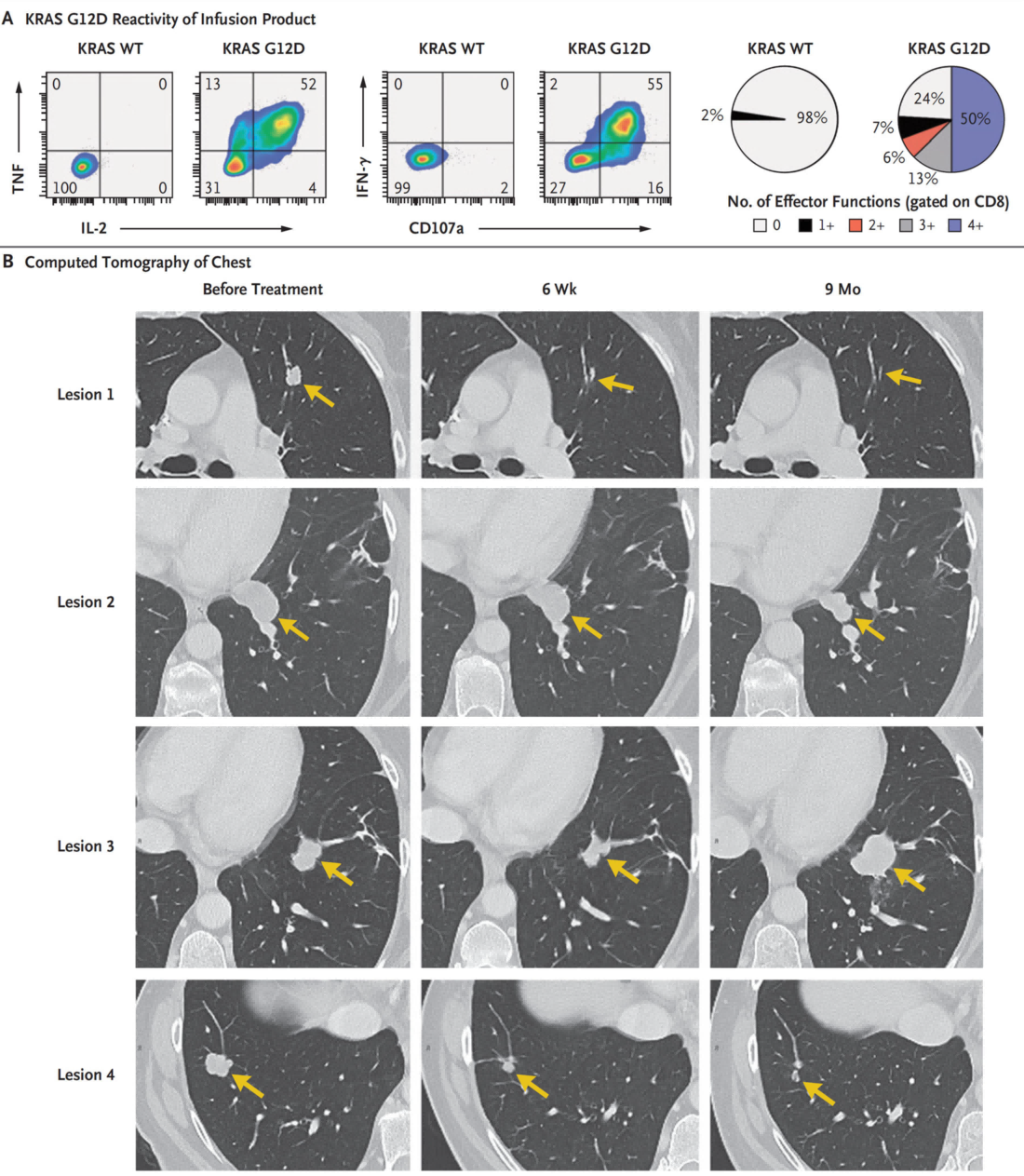
图5 KRAS G12D 特异性T细胞的过继转移【5】
(2)TCR-T细胞可靶向KRAS突变的肿瘤细胞
Wanget al., 2016在KRAS突变体免疫的HLA-A*1101转基因小鼠中分离到对KRAS G12V及G12D具有高反应性的TCR,转导TCR的PBMC细胞可识别多个KRAS突变的HLA-A*1101肿瘤细胞系;此外,在黑色素瘤、胰腺癌等小鼠模型中进一步验证了KRAS突变体特异性TCR-T细胞具有显著的抗肿瘤效果【6】。这些研究为KRAS驱动的肿瘤治疗提供新的思路。
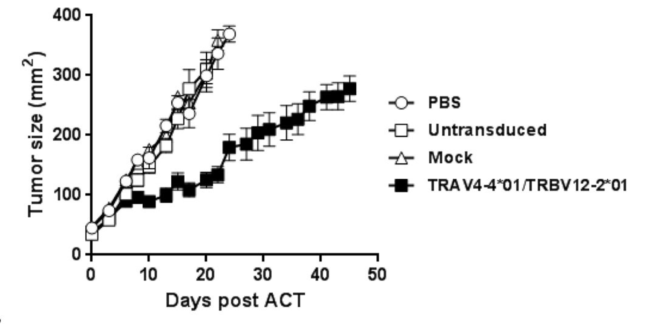
图6TCR-T细胞在胰腺癌小鼠模型中的抗瘤效果
注:TRAV4-4*01/BV12-2*01是可特异性识别KRAS G12D的肿瘤细胞的TCR-T细胞
4. KRAS MHC-1 Tetramer助力KRAS免疫治疗研发
CD8+T细胞上表达的T细胞受体(TCR)可以特异性识别MHC-抗原肽复合物,并与其结合,进而直接攻击并杀伤病原感染细胞、癌细胞等靶细胞。基于上述原理, Altman 等(1996年)使用MHC-抗原肽复合物形成的四聚体试剂,成功地利用流式细胞仪在单个细胞水平上对特异性T 细胞进行了检测。与传统的通过检测细胞因子、细胞毒性活性等间接检测方式不同,该技术不仅可以直接检测和分离抗原特异性T 细胞,也可以实现对其功能与表型等的详细分析,成为CTL细胞免疫应答监测的金标准,可在肿瘤免疫治疗领域广泛应用。
广州好芝生物科技有限公司研发团队结合KRAS表位肽研究最新成果【6,7】,采用最新的抗原表位肽预测算法,针对KRAS常见的突变位点:G12D、G12V、G12C、G12R、G13D,结合中国人群高频HLA-A*1101,设计生产了相应的KRAS MHC-I Tetramer,旨在助力KRAS疫苗、TCR-T等免疫治疗产品研发及治疗后临床疗效评估。
抗原突变位点 | MHC分型 | 多肽序列 | 位置 |
KRAS-G12D | A*1101 | VVVGADGVGK | 7~16 |
A*1101 | VVGADGVGK | 8~16 | |
KRAS-G12V | A*1101 | VVVGAVGVGK | 7~16 |
A*1101 | VVGAVGVGK | 8~16 | |
KRAS-G12C | A*1101 | VVGACGVGK | 8~16 |
A*1101 | VVVGACGVGK | 7~16 | |
KRAS-G12R | A*1101 | VVGARGVGK | 7~16 |
A*1101 | VVVGARGVGK | 8~16 | |
KRAS-G13D | A*1101 | VVVGAGDVGK | 7~16 |
A*1101 | VVGAGDVGK | 8~16 |
【1】Liu P.Y., Wang Y.J., Li X. Targeting the Untargetable KRAS in Cancer Therapy. Acta Pharmaceutica Sinica B., 2019 9(5):871-879.
【2】Waters A.M. & Der C.J. KRAS: the Critical Driver and Therapeutic Target for Pancreatic Cancer. Cold Spring HarbPerspect Med 2018;8:a031435
【3】Haigis K.M. KRAS Alleles: the Devil is in the Detail. Trends in Cancer, 200 No. 12
【4】Zhang Y., Ma J.A., Zhang H.X., Jiang Y.N., Luo W.H. Cancer Vaccines: Targeting KRAS-Driven Cancers. Expert Review of Vaccines 2020, ISSN: 1476-0584 (Print) 1744-8395
【5】Tran E., Robbins P.F., Lu Y.C., Prickett T.D., Gartner J.J., Jia L., Pasetto A., et al. T-Cell Transfer Therapy Targeting Mutant KRAS in Cancer. N Engl J Med. 2016; 375(23): 2255–2262.
【6】Wang Q.J., Yu Z.Y., Griffith K., Hanada K., Restifo N.P., Yang J.C. Identification of T-cell Receptors Targeting KRAS-mutated Human Tumors. Cancer Immunol Res. 2016 March ; 4(3): 204–214
【7】Wang Q., Douglass J., Hwang M.S., Hsiue E.H-C., Mog B.J., Zhang M., et al. Direct Detection and Quantification of Neo-antigens. Cancer Immunol Res. 2019 November ; 7(11): 1748–1754.